CONCEPTO DE PILA
Generalmente, una pila es un dispositivo que convierte energía química
en energía eléctrica por medio de una reacción química que tiene como fin el transporte de electrones, tras lo cual
cesa su actividad y han de renovarse sus elementos constituyentes al quedar sus características alteradas durante el proceso. Se
trata de un generador primario.
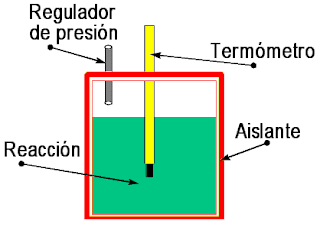
Básicamente consisten en dos electrodos metálicos sumergidos en un líquido, sólido o pasta, el electrolito, que es un conductor de iones.
Cuando los electrodos reaccionan con el electrolito, en uno de ellos (el ánodo) se producen electrones (oxidación), y en el otro (cátodo) se produce un defecto de los mismos (reducción). Cuando los electrones sobrantes del ánodo pasan al cátodo a través de un conductor externo a la pila, se genera una diferencia de potencial.
Cuando los electrodos reaccionan con el electrolito, en uno de ellos (el ánodo) se producen electrones (oxidación), y en el otro (cátodo) se produce un defecto de los mismos (reducción). Cuando los electrones sobrantes del ánodo pasan al cátodo a través de un conductor externo a la pila, se genera una diferencia de potencial.
La estructura fundamental de una pila consiste en dos electrodos, metálicos en muchos casos, introducidos en una disolución conductora de la electricidad o electrolito
DEFINICIÓN E HISTORIA
Consisten en dispositivos que usan las
emisiones de un isótopo radioactivo para generar electricidad. Al igual que los reactores nucleares, estas baterías generan
electricidad a partir de la energía atómica, pero se diferencian de
ellos en que no usan una reacción en cadena. Son muy costosos, en comparación con otras pilas más económicas y accesibles, pero tienen una vida útil muy larga
y una gran densidad de energía. Por ello se usan generalmente en
equipos que deben funcionar sin ser atendidos durante largos períodos
de tiempo, como son las naves espaciales y las estaciones científicas
automáticas.
Las baterías
atómicas, como ya se ha dicho anteriormente, usan radioisótopos que pueden producir partículas beta de baja energía
o partículas alfa con diferentes energías, siendo lo más habitual la emisión de partículas beta de baja energía. Éstas son necesarias para prevenir la
producción de radiación penetrante muy energética ("radiación de
frenado" o bremsstrahlung), lo cual precisaría el empleo de blindajes
pesados. Así, han probado radioisótopos como el tritio, níquel-63,
prometio-147, curio-242, curio-244 y estroncio-90, de los cuales está teniendo, actualmente, mayor importancia el tritio (isótopo natural del hidrógeno
La tecnología de baterías nucleares
comenzó en 1913, cuando Henry Moseley probó la
célula Beta, y recibió una atención considerable para aplicaciones
que requieren fuentes de energía de larga duración (usos
aeroespaciales durante los años 50 y 60). A lo largo de los años se
han ido desarrollado muchos tipos y métodos. Los principios científicos
son ya más que conocidos, mas la progresiva investigación, la primeriza nanotecnología y los nuevos
semiconductores de banda ancha han creado nuevos dispositivos, así
como propiedades materiales que no estaban a nuestro alcance
anteriormente.
Actualmente se están desarrollando
baterías que usan la energía de la desintegración de los
radioisótopos para proporcionar energía durante largos períodos de
tiempo (entre 10 y 20 años). Para ello, requiere una especial atención el hecho de aprovechar al máximo la energía desprendida en el choque de isótopos. Así las técnicas de conversión se pueden agrupar
en dos tipos: térmica y no térmica:
Los conversores térmicos (cuya
potencia de salida depende de una diferencia de temperatura)
incluyen generadores termoeléctricos y termoiónicos.
Los
conversores no térmicos (cuya potencia de salida es independiente
de una diferencia de temperatura), empero, extraen una fracción de la energía incidente del isótopo cuando se transforma en calor, en lugar de utilizar la energía térmica para mover electrones en un circuito.
Las baterías
atómicas tienen generalmente una eficiencia desde 0.1 hasta el 5%. Los
generadores betavoltaicos por su parte, tienen entre un 6 y 8%.
TÉCNICAS DE CONVERSIÓN TÉRMICA
Consiste en un electrodo caliente que emitiría electrones hacia otro más frío, produciéndose con ello potencia eléctrica útil. Se usa vapor de cesio para optimizar el funcionamiento de los electrodos durante la reacción.
Generadores termoeléctricos
Es una conexión en serie de termopares, que convierten el calor liberado por la desintegración de un material radioactivo en electricidad usando el efecto Seebeck, que consiste en la generación de una diferencia de temperatura debida a un voltaje eléctrico cuando una corriente se hace pasar por dos metales o semiconductores conectados por dos “junturas de Peltier” produciéndose finalmente una transferencia de calor de una juntura a la otra: una se enfría en tanto que otra se calienta. Los termopares metálicos no son muy eficientes en la conversión temperatura-electricidad. Sin embargo, usando materiales semiconductores como el telurio de bismuto o el silicio-germanio, se consiguen eficiencias mayores. Alcanzan un rendimiento de hasta un 10%.
Generadores termoeléctricos
Es una conexión en serie de termopares, que convierten el calor liberado por la desintegración de un material radioactivo en electricidad usando el efecto Seebeck, que consiste en la generación de una diferencia de temperatura debida a un voltaje eléctrico cuando una corriente se hace pasar por dos metales o semiconductores conectados por dos “junturas de Peltier” produciéndose finalmente una transferencia de calor de una juntura a la otra: una se enfría en tanto que otra se calienta. Los termopares metálicos no son muy eficientes en la conversión temperatura-electricidad. Sin embargo, usando materiales semiconductores como el telurio de bismuto o el silicio-germanio, se consiguen eficiencias mayores. Alcanzan un rendimiento de hasta un 10%.
Células termofotovoltáicas
 Usan el mismo principio que las células fotovoltaicas, a excepción de que convierten la luz infrarroja emitida por una superficie caliente, en electricidad, y no la luz visible. Las células termofotovoltaicas son ligeramente más eficientes que los pares termoeléctricos y se pueden combinar con ellos, doblando, en principio la eficiencia.
Usan el mismo principio que las células fotovoltaicas, a excepción de que convierten la luz infrarroja emitida por una superficie caliente, en electricidad, y no la luz visible. Las células termofotovoltaicas son ligeramente más eficientes que los pares termoeléctricos y se pueden combinar con ellos, doblando, en principio la eficiencia.
Conversores termoeléctricos AMTEC (Alkali-Metal Thermal to Electric Converter)
Son sistemas electroquímicos basados en el electrolito usado en las baterías de sodio-sulfuro, β-alumina. El dispositivo es una celda de concentración de sodio que usa un electrolito sólido, cerámico, policristalino de β-alumina, como separador entre una zona de alta presión que contiene vapor de sodio a 900 - 1300 K y una zona de baja presión que contiene un condensador para sodio líquido a 400 - 700 K. La eficiencia de las celdas AMTEC alcanza un 16% en el laboratorio y se predice que pueden alcanzar un 20%. Así, esta técnica se convertiría en la más eficiente de las cuatro ya mencionadas.
TÉCNICAS DE CONVERSIÓN NO TÉRMICAS
Los conversores no térmicos extraen una fracción de la energía nuclear al producirse calor en la desintegración nuclear. La salida no depende de las diferencias de temperatura como en los conversores termoeléctricos y termoiónicos. Se pueden agrupar en tres clases:
Generadores de carga directa
En el primer tipo, los generadores principales consisten en un condensador que se carga por la corriente de las partículas cargadas de una capa radiactiva depositada en uno de los electrodos. El espacio entre los electrodos suele ser el vacío. Se pueden utilizar partículas con carga negativa (partículas beta) o positiva (partículas alfa). Aunque esta forma de generador nuclear-eléctrico se remonta a 1913, lo altos voltajes y muy bajas corrientes que proporciona hacen que se hayan desarrollado pocas aplicaciones anteriormente. Actualmente se usan sistemas de osciladores/transformadores para reducir el voltaje, seguidos de rectificadores para transformar la corriente alterna de salida de nuevo en contínua.
Betavoltaicos
Estos generadores de corriente eléctrica usan la energía de una fuente radiactiva emisora de partículas beta (electrones). Una fuente común es el tritio, un isótopo natural del hidrógeno.
A diferencia de la mayoría de las fuentes de energía nucleares, que usan la radiación nuclear para generar un calor que posteriormente se convertiría en electricidad (generadores termoeléctricos y termoiónicos), los generadores betavoltáicos usan un proceso de conversión no térmico. Éstos se adaptan especialmente bien a las aplicaciones de baja potencia en las que se requiere una gran duración de la fuente de energía (dispositivos médicos implantables y aplicaciones aeroespaciales).
Baterías electromecánicas
Usan la acumulación de carga entre dos placas para acercar una de ellas, flexible, hacia la otra, rígida, hasta que ambas se tocan, se descargan y vuelven a la situación inicial, separándose así ambas placas. El movimiento mecánico que se produce en el proceso de acercamiento de ambas placas se emplea para producir electricidad mediante la deformación de un material piezoeléctrico.
Baterías electromecánicas
Usan la acumulación de carga entre dos placas para acercar una de ellas, flexible, hacia la otra, rígida, hasta que ambas se tocan, se descargan y vuelven a la situación inicial, separándose así ambas placas. El movimiento mecánico que se produce en el proceso de acercamiento de ambas placas se emplea para producir electricidad mediante la deformación de un material piezoeléctrico.
ACTUALIDAD
Las baterías a día de hoy se han convertido en algo casi imprescindible en el ambiente cotidiano (y más aún en el industrial) debido a los dispositivos electrónicos más comunes en la sociedad actual como los smartphones, los cuales están evolucionando muy rápidamente con procesadores más potentes, pantallas más grandes y conexiones inalámbricas más rápidas. Así, mientras que las baterías Li-Ion no han evolucionado en los últimos años, y ante una excesiva demanda energética, un posible sucesor serían las baterías nucleares, las cuales, con un tamaño inmensamente menor que el de las baterías ordinarias actuales, son capaces de otorgar una energía equivalente a 300 litros de gasolina. Así, las distintas investigaciones acerca de esta novedosa línea energética, se desarrollaron una serie de baterías para equipos electrónicos que pudieran soportar condiciones meteorológicas extremas, naciendo así las baterías betavoltaicas de NanoTritio, que transforman directamente la radiación nuclear del Tritio en energía eléctrica.
Empero, y dada su larga duración (aproximadamente 20 años), estas pilas son demasiado difíciles de conseguir a nivel cotidiano, debido al gran poder adquisitivo que requieren. Sin embargo, se calcula que entorno a un período de 2 a 5 años, se estima que podrían ser utilizadas en dispositivos de uso diario, como marcapasos o sensores, los cuales no dejarían de funcionar hasta pasados 20 años de duración energética.
FUENTES
- http://maikelnai.elcomercio.es/2009/10/10/muestran-pequenas-pilas-nucleares-que-funcionan-al-menos-durante-10-anos/- http://www.microsiervos.com/archivo/tecnologia/baterias-nucleares-nano-tritio.html
- http://elchapuzasinformatico.com/2013/01/ya-a-la-venta-las-baterias-nucleares-20-anos-de-energia-sin-recargas/
- http://es.wikipedia.org/wiki/Bater%C3%ADa_nuclear


















_2008.svg.png)