INTRODUCCIÓN
Con esta práctica se pretende estudiar el calor de
reacción en una reacción endotérmica, como es en nuestro caso. En
ella interviene la energía reticular del KNO3, en tanto
que ion, cuya energía reticular determinará la fuerza con que se
unen los componentes iónicos, la constante dieléctrica del H2O,
que permitirá su disociación iónica, además de su disolución y
reacción.
Al tratarse de una reacción endotérmica, se absorberá calor para que se pueda llevar a cabo la reacción, pues los productos son más inestables que los reactivos. Esta absorción de calor llevará consigo una disminución en la temperatura del sistema termoquímico.
DESARROLLO DE LA PRÁCTICA
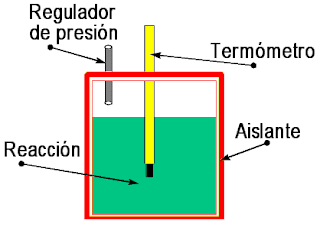 Para su realización, se llevaron a cabo una serie
de procesos, además de la utilización de distintos materiales:
Para su realización, se llevaron a cabo una serie
de procesos, además de la utilización de distintos materiales:Para empezar, se introducen en un calorímetro 15 mL de H2O, medidos anteriormente con una probeta, se cierra, y se mide la temperatura de su interior.
Seguidamente se pesan, con un pesasustancias, 3 g de KNO3 en la balanza, y se anota la cantidad exacta pesada (pues suelen haber pequeños desviamientos con respecto a la cantidad requerida).
Una vez hecho lo anterior, se introduce el KNO3 en el calorímetro, se agita levemente, para mezclarlo con el agua del interior y evitar que se peguen las sustancias en las paredes del recipiente.
Finalmente, se anota la temperatura resultante de la
reacción (la temperatura final), percatándose de su disminución
con respecto a la primera anotada.
DATOS OBTENIDOS
T(inicial) = 17ºC
T(final) = 11ºC
Masa (H2O) = 15 g Masa (disolución) = 18,03 g
Masa (KNO3) = 3,03 g
Qdisolución=ce⋅md ⋅ΔTQH2O=1⋅18,03⋅6QH2O=452,1924 J / g
QKNO3=ce⋅md⋅ΔTQKNO3=0,09636⋅18,03⋅6QKNO3=0,01 J / g
RELACIÓN TEÓRICA Y CONCLUSIONES
Esta
experiencia, así como los resultados obtenidos tras ella, podrían
relacionarse con la energía libre de Gibbs ΔG, en tanto que esta
reacción es espontánea, aun siendo una reacción endotérmica, en
la cual nos encontramos que ΔH > 0 y que ΔS >0, de tal modo
que sería espontánea en el intervalo de Tª en el que se ha llevado
a cabo la experiencia, pues en estos casos el proceso será
espontáneo siempre y cuando trabajemos con Temperaturas altas
(TΔS > ΔH), para que, finalmente ΔG < 0 y la reacción, por
ende, espontánea.
Con respecto a la entropía, se concluye que el sistema es entrópico, pues, de no ser así, la reacción no se habría llevado a cabo espontáneamente, ya que si ΔH > 0 y TΔS < 0 la reacción es no espontánea. Siendo nuestro caso una ΔS > 0, establecemos que las temperaturas en las que se ha dado la reacción son lo suficientemente altas (290 K) como para que ΔG < 0. posiblemente, a una temperatura más baja, como 273 K, la reacción no se podría haber llevado a cabo, pues a esa temperatura el agua se condensa, y, por tanto, disminuye la entropía en el sistema, haciendo imposible la espontaneidad de la reacción.
MEJORAS POSIBLES DE LA EXPERIENCIA
Con
el uso de un calorímetro mejor aislado del exterior, y un agitador
insertado en el mismo, la reacción se podría haber llevado a cabo
de una forma más precisa, y con menos pérdida de energía, o
variación con respecto al entorno, en forma de calor. Además, con
el uso de termómetros electrónicos y probetas más precisas se
podría llevar a cabo lo anteriormente comentado: una mayor precisión
en los cálculos.
Al agitador se le podría unir un motor que llevase a cabo un movimiento aproximadamente uniforme, impidiendo grandes variaciones en la aceleración de la agitación del mismo compuesto, tal que las pérdidas de sustancia pegadas en las paredes del calorímetro sean las mínimas.
No hay comentarios:
Publicar un comentario